Piattaforma RNA
Il lavoro pionieristico di Sarepta con gli oligomeri morfolino fosforodiamidati (phosphorodiamidate morpholino oligomer, PMO) è alla base delle nostre terapie di salto (skipping) dell’esone.
La nostra chimica di nuova generazione è chiamata PPMO perché aggiunge un peptide alla struttura del PMO, con l’obiettivo di aumentare la penetrazione nei nuclei cellulari, e ha il potenziale di espandere il nostro portafoglio terapeutico.
L’RNA e il suo ruolo nella malattia genetica
Le origini delle malattie neuromuscolari e del sistema nervoso centrale di tipo ereditario sono quasi sempre riconducibili a mutazioni genetiche che interferiscono con la produzione di proteine cruciali.
I geni sono segmenti di DNA e si trovano in quasi tutte le cellule dell’organismo. Quando l’organismo ha bisogno di produrre una proteina, le informazioni nel DNA vengono trasmesse a una molecola simile, nota come RNA. Infine, una forma di RNA chiamata RNA messaggero (mRNA) trasmette le istruzioni a una particella nella cellula, che utilizza le istruzioni per assemblare la proteina. Una malattia genetica si verifica quando una mutazione viene trasmessa all’RNA messaggero, creando un errore nelle istruzioni necessarie per produrre una determinata proteina.
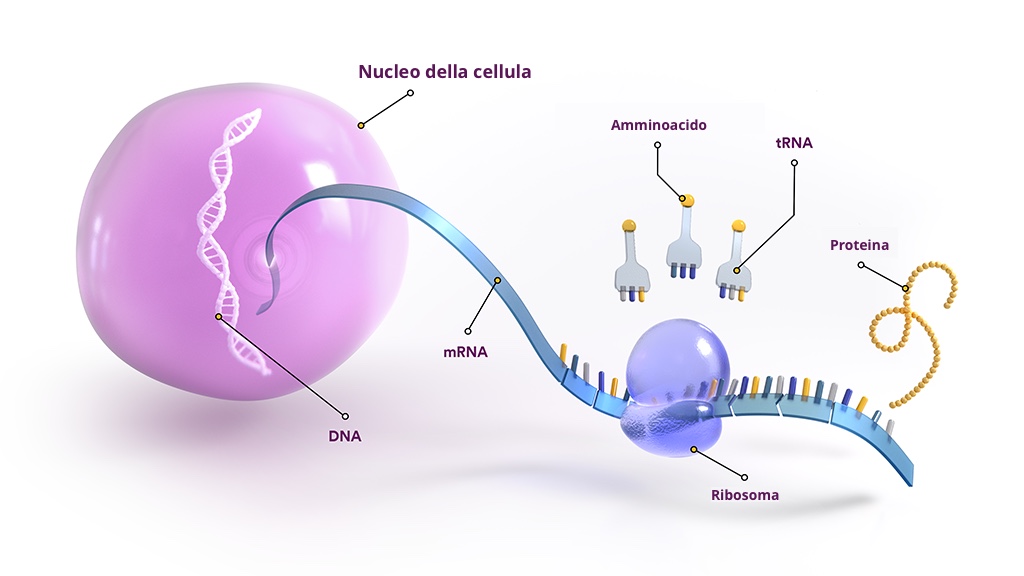
Tecnologie RNA: PMO e PPMO
PMO
Gli oligomeri morfolino fosforodiamidati, o PMO, sono molecole sintetiche modellate imitando la struttura naturale dell’RNA. Mentre i PMO hanno le stesse basi di acido nucleico che si trovano nell’RNA, essi sono legati ad anelli esagonali di morfolino invece di anelli pentagonali di ribosio. Inoltre, gli anelli di morfolino sono legati gli uni agli altri da collegamenti di fosforodiamidato invece dei collegamenti di fosfodiestere che si trovano nell’RNA. Ciò consente ai PMO di legarsi a specifiche sequenze di RNA messaggero precursore (pre-mRNA), pur rimanendo altamente resistenti alla degradazione.
PPMO
Gli oligomeri morfolino fosforodiamidati peptide-coniugati, o PPMO, sono terapie di nuova generazione a base di PMO, proprietarie di Sarepta, in fase di sviluppo e specificamente progettate per aumentare la penetrazione nei tessuti rispetto ai PMO. Studi non clinici hanno dimostrato una distribuzione mirata alle cellule dei muscoli scheletrici, cardiaci e lisci, nonché un conseguente aumento nella modifica dell’mRNA. L’obiettivo di questi programmi di sviluppo è capire se l’aggiunta del peptide possa migliorare l’efficacia e ridurre il dosaggio, oltre ad ampliare la gamma di malattie che il farmaco può trattare.
Salto dell’esone
Molte malattie sono causate da una mutazione genetica in un particolare gene. Più comunemente mancano uno o più esoni (parti del gene) e questo causa errori nelle istruzioni per la produzione di una proteina specifica. Ciò comporta che l’organismo non sia in grado di produrre una quantità sufficiente di tale proteina o non sia in grado di produrla affatto. L’obiettivo del salto dell’esone è agire sull’RNA per consentire all’organismo di produrre una versione della proteina mancante per bypassare la mutazione.
Esempio di salto dell’esone
Un gene è costituito da esoni (porzioni di un gene) collegati tra loro per fornire istruzioni per la produzione di una specifica proteina.
Ciascun esone si collega con gli esoni vicini in un modo specifico. L’esone 43, per esempio, si collega da un lato con l’esone 42 in un modo specifico e dall’altro con l’esone 44, anche in questo caso in un modo specifico.
Se manca l’esone 43, l’esone 42 non può collegarsi direttamente all’esone 44 perché i loro connettori non si incastrano tra loro e dato che non si incastrano tra loro, l’organismo non è in grado di leggere le istruzioni genetiche per la produzione della proteina.
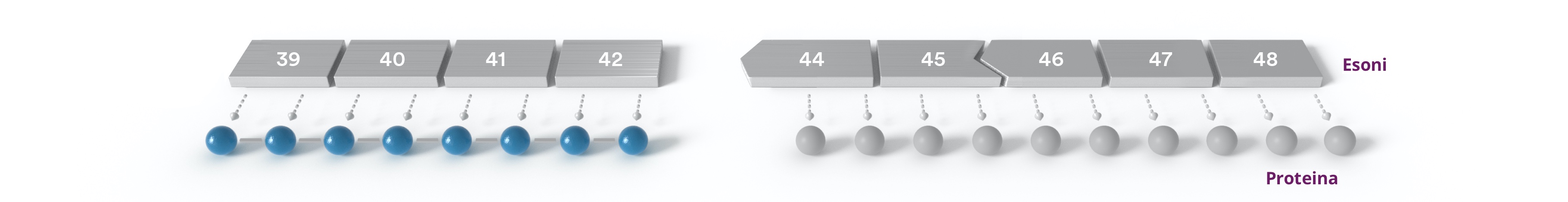
Saltare gli esoni
Nascondendo determinati esoni, possiamo “saltare” la loro posizione e collegarci a un esone con il connettore giusto. Questo consentirebbe la produzione di una forma abbreviata e potenzialmente funzionale della proteina mancante.
In questo esempio, il PMO dirige il meccanismo dello splicing per “saltare” un esone durante l’elaborazione del pre-mRNA. Di conseguenza, l’mRNA alternativo consente la produzione di una forma più breve della proteina mancante. 
